热休克蛋白加热冷却台
热休克蛋白(HSP)是细胞响应暴露于压力条件下而产生的蛋白质家族。几乎在所有生物体中都发现HSPs,从细菌到人类。 HSP主要起分子伴侣的作用,促进其他细胞蛋白质的折叠,防止蛋白质聚集,或将不正确折叠的蛋白质靶向特定的降解途径。一些HSP在正常生理条件下以低水平表达,但是在细胞应激反应中表现出显着增加的表达,其他组分表达。特定的HSP通过直接与凋亡途径的关键组分相互作用而在调节凋亡中发挥作用。
热休克蛋白(HSP)的研究包括基因表达和控制应激基因调控的复杂信号转导途径;其他研究的重点是应激蛋白作为分子伴侣的作用,调节蛋白质折叠和转运的各个方面以及应激蛋白在人类疾病中的作用。
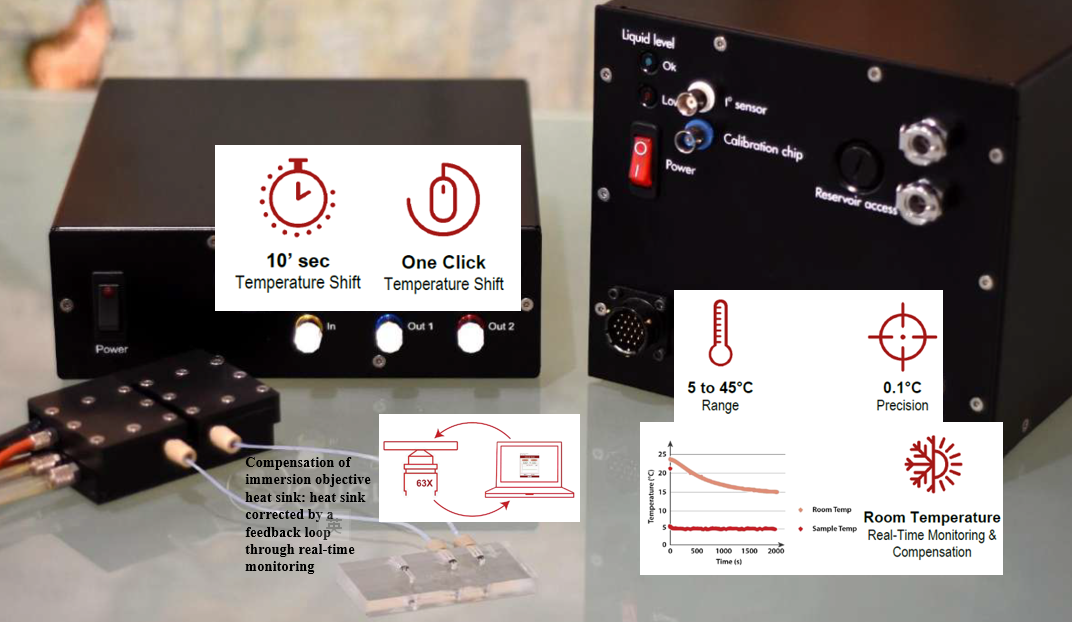
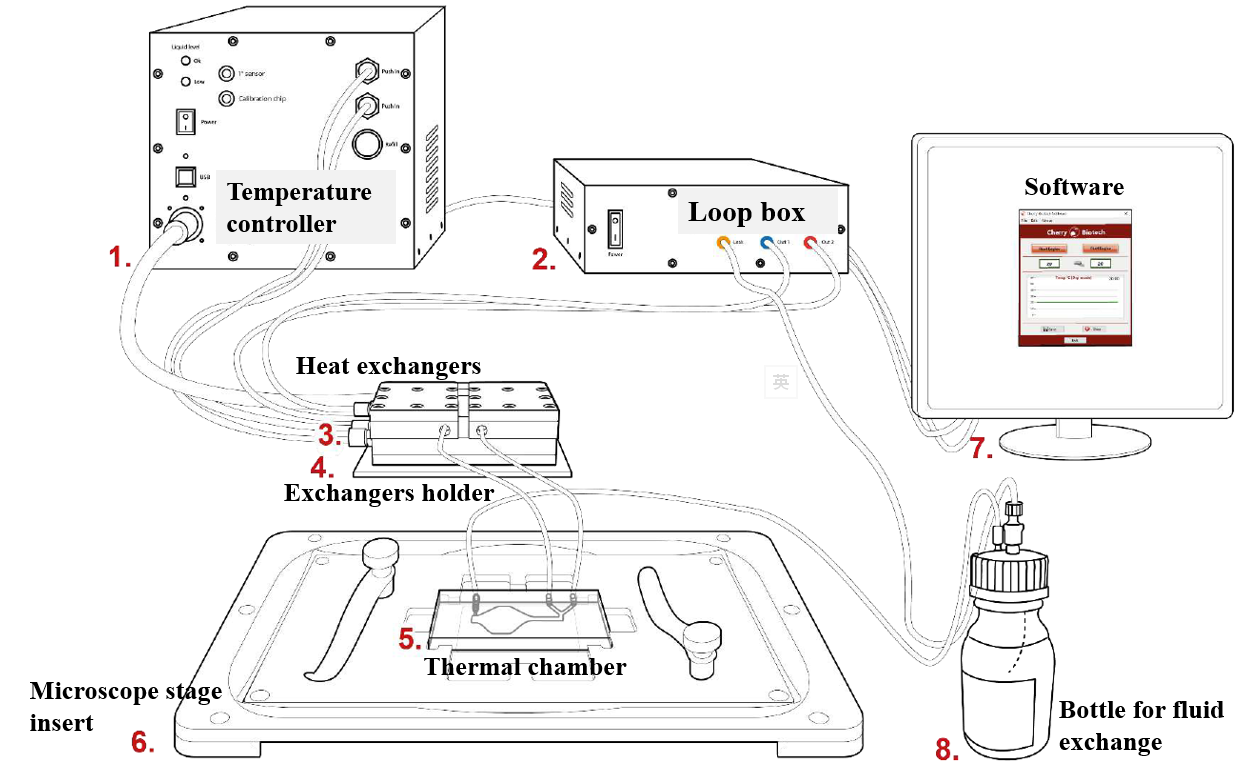
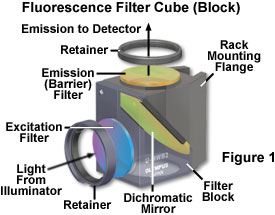
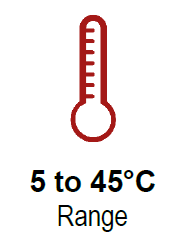
在5-45°C范围内(+/- 0.3°C精度)的HSP加热冷却台(HSP H&C台)适用于为超快速qPCR军事应用设计的原始设备,以创造世界上最快的活细胞加热器冷却器成像显微镜现在可以实时控制您最喜爱的分子过程,观察与活体温度相关的动态事件,并发现不希望的机制。不管两个温度之间的差异如何,您都可以在10秒内更改温度。它可以安装在任何直立和倒置的显微镜模型上,通过用户友好的软件很容易安装和控制。


HSP应用示例:
1.果蝇的发育周期取决于温度,在25°C时为8.5至9天,由于生长不理想而在较高和较低温度下减慢,并被用作研究人类疾病(包括癌症)的动物模型,神经系统疾病和罕见疾病。果蝇在35-37℃热激,而当温度升高到高于其正常体温37℃(例如41-42℃)几度时诱导人或小鼠细胞产生Hsps。
2.线虫中热感觉神经元的功能研究
3.温度敏感性(Ts)突变体表型的研究是基因鉴定和解剖必需基因功能的基础。 Ts突变通常是错义突变,其在标准(允许)低温下保留特定必需基因的功能,缺乏在限定的高(非允许)温度下起作用,并且在中间(半允许)温度下表现出部分(亚形)功能。这些突变体使得通过将细胞转移到非允许温度来控制基因或基因产物失活后的生理变化的分析成为可能,提供了分析基因功能的有效方法。虽然广泛的基于RNAi的筛选已经鉴定了成体性腺正常发育所需的许多必需的秀丽隐杆线虫基因,但对成体卵子发生过程中膜动态的调节知之甚少。鉴于种系发育和蛋壳形成中膜运输的已知要求,筛选大量温度敏感的胚胎致死线虫突变体的实验是针对性腺发育和蛋壳生产中的缺陷进行的。将秀丽隐杆线虫的TS突变株保持在15℃的允许温度下。通过选择在允许温度下生长的L4雌雄同体并将它们移动到26℃至少6小时,然后将胚胎分离成水,进行胚胎表型表征。用于测定渗透性屏障缺陷的染料渗透性测定描述于Carvalho等人。通过将L1幼虫的同步群体移动至26℃几(3-5)天并评分成人生殖细胞形态来进行胚后表型表征。
4.酵母细胞:
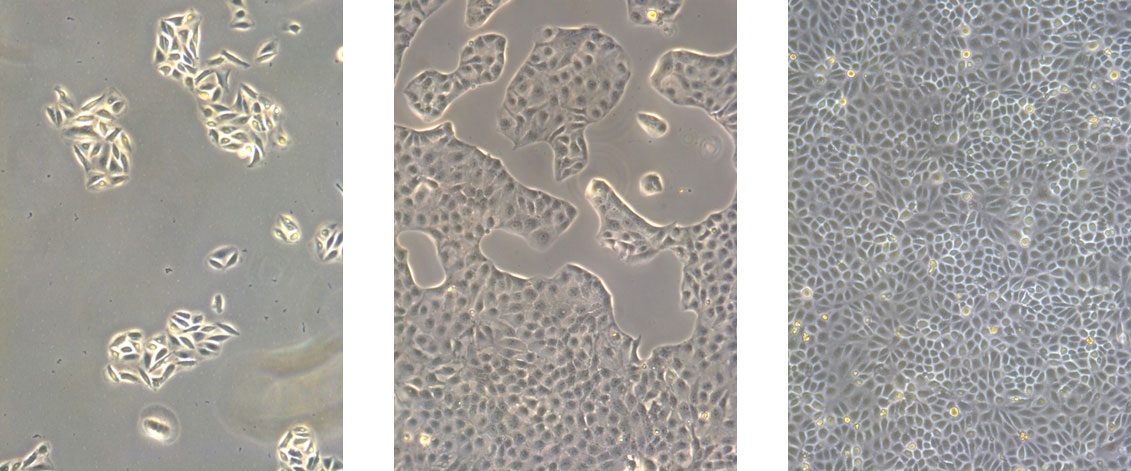
- 分裂酵母温度敏感性突变体促成了涉及酵母生物学的新基因的发现。温度敏感突变通常是错义突变。突变的蛋白质在低温,允许温度下保留其功能,但在更高的限制温度下,它们变得无活性。裂殖酵母生物学对温度本质上敏感。
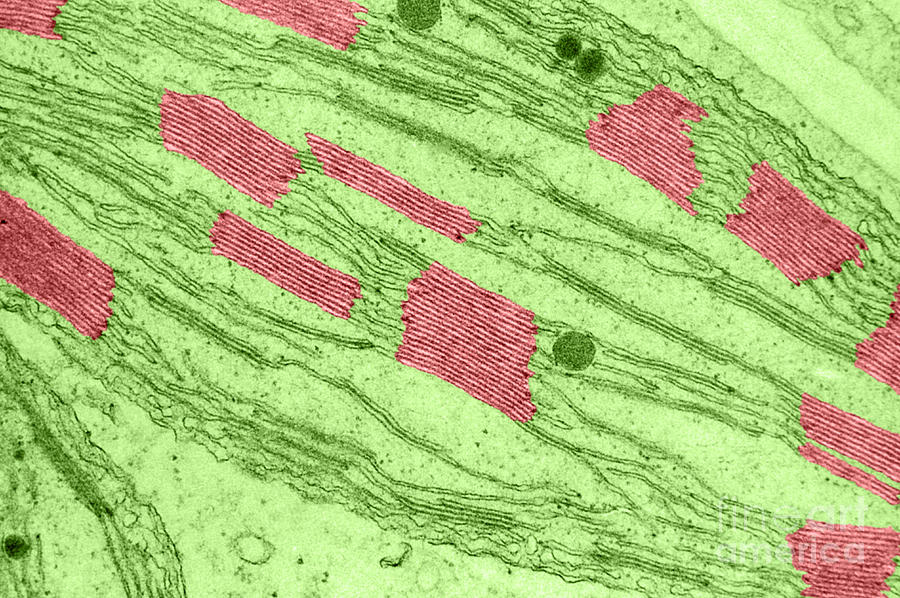
- 裂殖酵母细胞在25℃下生长用于实时成像。细胞在10秒内从25℃转移至5℃,诱导微管解聚。在将温度回升至25℃时发生微管重复聚合。
- 在限制性温度(36.5℃)下,裂殖酵母cdc25-22细胞在G2 / M转换中被阻断4小时。通过快速转变(10秒)进入允许温度(25℃)实现细胞周期的同步释放。分隔指数是裂殖酵母细胞进入细胞周期的指标。当在16℃阻断nda3-KM311突变体并在释放至32℃时测量分隔指数时也获得高同步性。
- 通过记录仪分析在10℃和30℃之间的酵母细胞胞吐作用的记录时间差,以确定在不同温度下的胞吐事件的寿命。
5. 热休克蛋白最近被认为在调节免疫反应中具有潜在的作用。
- 已知它们以非共价方式与免疫原性肽结合。
- 当肿瘤细胞暴露于高温时,热休克蛋白 - 肽复合物呈现在细胞表面上。这些复合物可以通过主要组织相容性复合物(MHC)I类分子被抗原呈递细胞(树突细胞)识别。一旦树突状细胞接受这种刺激,它们就会迁移到淋巴结,在那里它们引发T细胞淋巴细胞对表达肽 - 热休克蛋白复合物的细胞产生细胞毒性。已显示高温增加树突细胞迁移的速率。
- 热休克蛋白还诱导树突细胞成熟和促炎细胞因子释放。
- 热休克蛋白的细胞膜定位还通过激活自然杀伤(NK)细胞来激活先天免疫系统。
6. 其他细胞应激源如病毒感染,发热,缺氧和辐射暴露也被证明可以上调热休克蛋白。因为该过程似乎是天然发生的,所以已经努力利用高温来产生肿瘤来源的疫苗并增强对这些疫苗的体内反应。据报道,高温还能上调许多促炎性细胞因子和粘附分子,促进免疫细胞跨内皮细胞运输以进入肿瘤间质。此外,伴有或不伴有相关肽的脱落的热休克蛋白可作为趋化因子将免疫细胞(特别是巨噬细胞)吸引到已经受热应激的组织区域。此外,HSP表达受到动脉粥样化形成的所有步骤中涉及的不同刺激的调节,包括氧化应激,蛋白水解攻击或炎症。
针对不同应用的配件包和方法:


























































 关闭返回
关闭返回